Atomi tömeg vs. atomi szám

Tartalom
- Tartalom: Az atomtömeg és az atomszám közötti különbség
- Mi az atomtömeg?
- Mi az atomi szám?
- Főbb különbségek
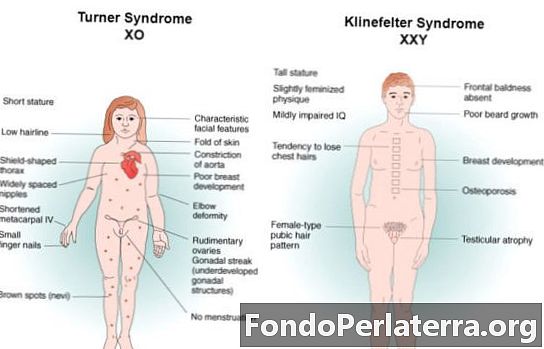
Az atomtömeg és az atomszám a kémia és a fizika fogalmaiban általánosan használt két kifejezés. A tudomány kulcsfogalmainak megértéséhez mindkét kifejezés jelentős szerepet játszik. Ez a két kifejezés az esetek többségében zavaró az emberek számára, mindkettőt felváltják. Pontosan nagyon különlegesek egymástól, bár mindkét kifejezés tartalmaz némi hasonlóságot, de különböznek egymástól. A különféle anyagok, anyagok és elemek tulajdonságai és jellemzői nem érthetők e kifejezések jelentésének megértésével. Az atomi számot arra használják, hogy világosan meghatározzák az elem fajtáját, amely az anyag, vagy esetleg az anyag. Meghatározzák és írják le, mint egy elem atommagjában található protonok számát, míg másrészről az atomtömeg határozottan az az elem, amely az elemhez kapcsolódó adott magban mind a protonok, mind a neutronokhoz kapcsolódik. Az elektronok valójában nem súlyosak, ezért az atomtömeg meghatározása valójában a protonokkal járó mennyiség hozzáadásával történik a neutronokhoz. Ezenkívül atomtömegként is ismert.

Tartalom: Az atomtömeg és az atomszám közötti különbség
- Mi az atomtömeg?
- Mi az atomi szám?
- Főbb különbségek
- Videó magyarázat
Mi az atomtömeg?
A tömegszámot vagy atomtömegszámot (A) jelölik, amelyet általában az elem felső oldalán írnak, atomtömegszámnak vagy talán nukleonszámnak is hivatkoznak, határozottan a protonok és neutronok (amelyek együttesen nukleonoknak nevezik őket egy atommagban. Ez határozza meg az atomok adott atomtömegét. A protonok és a neutronok egyaránt baryonok miatt az A tömegszám hasonló a B baryonszámhoz hasonlóan, mivel az egész atom vagy akár az ion adott atommagja. A tömegszám teljesen különbözik a kémiai anyag alkotóeleme minden egyes különálló izotópjánál. Ez egyszerűen nem egyezik meg az atomi számmal (Z). A tömegszámot néha az elem neve után mutatják be, vagy talán úgy, hogy felső elemként jelennek meg az elem szimbólumának bal oldalán. Például a legjellemzőbb szénatomot tartalmazó izotóp határozottan a szén-12 vagy 12C, amely 6 protont és 6 neutronot tartalmaz. A teljes izotópjel feltétlenül szintén tipikusan atomszámot hordozna. A tömegszámot nem szabad összekeverni egy másik hasonló kifejezéssel, amely az elem relatív atomtömege.
Mi az atomi szám?
Az atomszámot „Z” jelöli. A kémia és a fizika szempontjából jellemzően a kémiai elemhez társított atomszám (protonszámnak is nevezzük) határozottan az a protonszám, amely tökéletesen helyezkedik el az atom atomjához kapcsolódó magban, és ezért hasonló az adott mag töltési számához. Ezt valóban hagyományosan a Z kép ábrázolja. Az atomszám kizárólag egy kémiai elemet határozza meg. A nem feltöltött atomon belül az adott atomszám szintén összehasonlítható az elektronok számával. A Z atomszámnak tévesen meg kell állnia, mint a tömegszámot, A, amely a nukleonok száma, a neutronok mennyisége, N, az atomhoz kapcsolódó neutronszámként ismeri el; tehát A = Z + N (ezek az összegek mindig egész számok lesznek). Mivel a protonok és a neutronok tömege nagyjából megegyezik (valamint az elektronok tömege sok szempontból egyértelműen elhanyagolható), és a nukleonkötéssel járó tömegprobléma általában kisebb az adott nukleon tömeghez képest, ezért a az atomot, amikor csak egy atomtömeg-egységen belül feltüntetik, pontosan ugyanazzal a Z atomszámmal rendelkező atomok vannak, ugyanakkor megkülönböztethető N neutronszámok, és ezért külön atomtömegek, izotópokként vannak besorolva.
Főbb különbségek
- Az atomszámot „Z”, míg az atomszámot „A” képviseli.
- Az atomtömeg nem határozza meg az elem típusát, míg az atomszám meghatározza az elem típusát.
- Az atomtömeget ugyanazon elem különböző izotópjai mutatják, míg az atomszám esetében nem ez a helyzet.
- Az atomtömeget az atomtömeg-egységben (amu) mérjük, míg az atomszám csak egy szám.
- Az elektronok száma mindig egyenlő az atomszámmal, de nem egyenlő a tömegszámmal.
- Ha az atomi szám magas, akkor az azt jelzi, hogy az atomtömeg is magas lesz.